The soap
 The first evidence of the existence of soap dates back to ancient Mesopotamia, around 2800 B.C. age when goes back a recovery, made during excavations in the area of Babylon, of a substance similar to what we now call “Soap”. The discovery of soap probably is due to the observation of the effect that had the leaches on animal or vegetable fat present on clothes, that they were trying to wash, once subjected to heat.
The first evidence of the existence of soap dates back to ancient Mesopotamia, around 2800 B.C. age when goes back a recovery, made during excavations in the area of Babylon, of a substance similar to what we now call “Soap”. The discovery of soap probably is due to the observation of the effect that had the leaches on animal or vegetable fat present on clothes, that they were trying to wash, once subjected to heat.
From a chemical point of view, soap is a salt of long chain carboxylic acids and are obtained through a reaction of .
So to create the soap you have to make react a fat, tallow or vegetable oil (typically, olive oil), with an alkaline base such as sodium hydroxide or potassium hydroxide (that in the leaches were present because were contained in the ash being used to prepare it.)
The ingredients for the creation, even domestic, of soap are available with relative ease and, on the internet, it is possible to find various recipes for produce it at home, either by using the caustic soda or using the ashes.
Starting from olive oil, you will get the famous Marseille soap and Castile soap, by using sodium hydroxide (lye), obtaining a product of hard consistency. If you use potassium hydroxide (potash) you get a soap of soft consistency.
Until the end of 1800, the soap was a good that only noble and extremely rich people could afford, both because of high production costs, which included the use of huge amounts of wood, and because of the very high fees that were applied.
Finally, in 1879, Nicolas Leblanc discovered what was then called the for preparing caustic lye from a saline solution.
Nowadays the Leblanc process was superseded by the , patented in 1861 by Belgian chemist Ernest Solvay, but had certainly the merit of allow the use of soap to a wider number of users.
These types of soap, made with natural raw materials, collected today a renewed success in public opinion. Let’s note, however, that the main function of soap to remove dirt and dissolve fat, when applied to the care of the body, eventually removes even the layer of slightly acidic fat (pH about 5.5) that the skin produces to protect itself.
The Marseille soap also, in its original formulation, is from neutral to alkaline and, as such, in addition to free the skin of its protective layer, damages it and irritates it.
To overcome these drawbacks, soaps for personal use are often added with fat and acidifying substances to bring them to a level of better compatibility with the human skin. The judgement of this type of soaps of “antique flavor” must be expressed with care because the cleaning power of soaps is almost always the same and the added substances often serve only to enhance the appearance and/or the smell of the product (and to bump up the price).
Once that the action of surfactants in removing dirt was clarified, soap of Marseille was soon replaced or supplemented by other substances more specific and efficient for the various uses, as we shall see in the next section.
La saponificazione è una reazione di idrolisi effettuata su un estere in ambiente basico. Infatti come mostrato sotto, viene fatta avvenire utilizzando come reagente una base forte come l'idrossido di sodio o di potassio.
Si parla di saponificazione quando l'estere di partenza ha un peso molecolare relativamente elevato, con una catena di almeno 12 atomi di carbonio.
Il nome saponificazione deriva dal fatto che questa reazione porta alla formazione del sapone di uso comune.
Gli esteri sono sostanze organiche formate da due radicali organici legati dal gruppo funzionale [-O-C=O-]. Nel caso della preparazione del comune sapone, si parte dai trigliceridi di acidi grassi presenti in grassi animali, come il sego bovino, o olii vegetali come l'olio di oliva.
La reazione che avviene in questo caso è descritta dallo schema seguente:
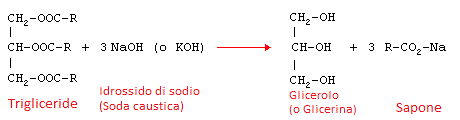
In cui vediamo a sinistra la struttura dell'estere formato dal glicerolo (detto anche glicerina) più i radicali "R" dell'acido grasso. Nel caso dell'olio di oliva questo radicale potrebbe essere quello dell'acido oleico CH3(CH2)7CH=CH(CH2)7COOH di cui l'olio di oliva è costituito per buona parte.
Il risultato della reazione è glicerolo più il sale dell'acido grasso considerato che nell'esempio, avendo usato idrossido di sodio nei reagenti (NaOH) sarà un sale di sodio.
Il processo Leblanc è procedimento industriale che permette di produrre il carbonato di sodio (soda) a partire da una soluzione salina di cloruro di sodio (sale marino) e carbonato di calcio (calcare) mediante l'utilizzo di acido solforico e carbone.
Esso fu brevettato nel settembre del 1790 dal medico francese Nicolas Leblanc e conobbe subito una rapida diffusione specialmente in Francia e Inghilterra.
Il processo prevede due step successivi di reazioni chimiche:
nel primo step il cloruro di sodio viene convertito in solfato di sodio
![]()
nel secondo step, aggiungendo il carbonato di calcio e il carbone, si ottiene il carbonato di sodio.
![]()
A livello industriale, come si può vedere dalla prima reazione, fra i prodotti troviamo il solfato di sodio che rientra nel secondo step ma anche una notevole quantità di acido cloridrico gassoso. Nei primi decenni di attività delle fabbriche Leblanc l’acido cloridrico veniva disperso direttamente nell’aria.
In alternativa, specie in Francia, gli scarichi subivano un lavaggio in giare di grès piene d’acqua collegate in serie, oppure venivano convogliati in una grande camera di piombo dove reagivano con vapori ammoniacali prodotti dalla calcinazione di scarti animali, dando luogo alla formazione di cloruro d’ammonio. Si è valutato che negli anni ’40 del XIX secolo, in Inghilterra, nell’area del Merseyside, circa 100 mila tonnellate di sale siano state convertite in alcali, dando come sottoprodotto 60 mila tonnellate di acido.
 Gli addetti alla produzione che, prima dell’introduzione dei forni meccanici (mostrati nell'immagine), mescolavano manualmente l’acido solforico con il sale in grandi vasche di ghisa, si ammalavano rapidamente.
Gli addetti alla produzione che, prima dell’introduzione dei forni meccanici (mostrati nell'immagine), mescolavano manualmente l’acido solforico con il sale in grandi vasche di ghisa, si ammalavano rapidamente.
A causa del gas il bestiame soffocava, le popolazioni circostanti soffrivano di vari disturbi, i manufatti metallici e i materiali da costruzione venivano corrosi, la vegetazione e le colture agricole deperivano, i fiumi diventavano “neri come l’inchiostro” e le piogge acide completavano
l’opera di devastazione.
Inoltre il solfuro di calcio, anch'esso nocivo, veniva accumulato senza protezione alcuna all’esterno delle fabbriche, cosicché per azione delle piogge acide produceva idrogeno solforato, tossico e maleodorante.
Nel 1863 fu promulgata la legge denominata "Alkali Act" che cercava di porre una regolamentazione allo smaltimento dell'acido cloridrico prodotto durante il processo Leblanc e in seguito l'invenzione del processo Solvay che permetteva di ottenere il carbonato di sodio senza scarti tossici determinarono l'abbandono del processo Leblanc su scala industriale.
Il processo Solvay per la produzione del carbonato di sodio deve il suo nome al chimico belga Ernest Solvay che lo brevettò nell'aprile del 1861.
Grazie al processo Solvay si può produrre a livello industriale sia il carbonato acido di sodio o idrogenocarbonato di sodio NaHCO3 (noto comunemente come bicarbonato di uso domestico) sia il carbonato di sodio Na2CO3 usato in altri procedimenti industriali come per esempio quello per la produzione del sapone.
Il processo solvay è usato ancora oggi, anche se in declino in quanto risulta più economico ricavare il carbonato di sodio sfruttando il "trona", che è un minerale (carbonato acido di sodio biidrato) estraibile dai laghi salati di tutto il mondo.
Nel processo Solvay si sfrutta la differenza di solubilità in acqua a 25°c tra NH4Cl (37,3 g/100 cc di soluzione) ed il NaHCO3 formato (10,0 g/100 cc) nella seguente reazione tra una soluzione di NaCl (cloruro di sodio) ed NH3 (ammoniaca) con CO2 fatta gorgogliare nella soluzione dove forma acido carbonico (H2CO3):
NaCl + NH3 + H2CO3 → NaHCO3 + NH4Cl
Questa reazione é di equilibrio, ma viene continuamente spostata a destra dalla precipitazione del sale che viene così separato per filtrazione.
La reazione in acqua del bicarbonato di sodio é leggermente basica per l’ idrolisi dello ione HCO3- ; una soluzione di 50 g/l, infatti, ha un pH = 8,5 a 25°c.
Una sua proprietà chimica importantissima, sfruttata nel processo Solvay, é che si decompone sopra i 50°C in carbonato di sodio (Na2CO3) e anidride carbonica (CO2):
2NaHCO3 → Na2CO3 + CO2 + H2O
Così il prossimo passo del processo Solvay consiste nel recuperare il NaHCO3 formato e scaldarlo decomponendolo a circa 70°C.
Il cloruro di ammonio NH4Cl della soluzione viene riciclato recuperando l’ NH3 utilizzando l'ossido di calcio (calce viva) secondo la seguente reazione:
CaO + H2O → Ca(OH)2
Ca(OH)2 + 2 NH4Cl → CaCl2 + 2 NH3 + 2 H2O
Siccome l'ammoniaca viene reimmessa nel ciclo, l'unico prodotto di scarto del processo è il cloruro di calcio CaCl2 che può essere commercializzato e utilizzato come anticongelante.
Il Na2CO3 è un sale alcalino e caustico. Una soluzione di 50 g/l a 25°C ha un pH di 11,5
 -0
-0  )
)
Leave a Reply