Glucosio, fruttosio, galattosio… la parola al chimico
Temo che questo paragrafo possa risultare noioso a molti a causa della quantità di nomi di sostanze chimiche che vi sono riportate. Alcuni dei nomi, fra cui i più importanti sono proprio quelli riportati nel titolo del paragrafo, sono comunque di uso piuttosto comune e spesso usati anche nella pubblicità. Trattandosi inoltre di sostanze che, per vie più o meno dirette, vanno a finire nella nostra pancia, forse un piccolo sforzo per dare un nome più preciso a ciò che mangiamo non sarà così drammatico.
Come al solito gli approfondimenti più spinti sono relegati in appositi box ipertestuali.
- Il glucosio
Il glucosio entra nel ciclo alimentare degli grazie all’attività fotosintetica delle piante. Esso è chimicamente formato a partire da molecole inorganiche semplici come acqua e anidride carbonica avendo l’ossigeno come prodotto di scarto:
6CO2 + 6H2O = C6H12O6 + 6O2
Per le cellule autotrofe, che lo sintetizzano sfruttando l’energia proveniente dal sole, si tratta del primo mattone per costrure polisaccaridi complessi come la cellulosa, per le cellule eterotrofe rappresenta la più importante fonte di combustibile chimico in quanto è il punto di partenza per le reazioni della .
La glicolisi, da due parole greche che significano “dolce” e “tagliare”, è il processo anaerobico grazie al quale il glucosio viene consumato per produrre 2 molecole di ATP che è la molecola che funge da moneta energetica nelle varie reazioni cellulari. Fra i prodotti della glicolisi vi è il piruvato.
Negli organismi anaerobici o nelle cellule, in assenza di ossigeno, il piruvato viene degradato in acido acetico o acido lattico a seconda del tipo di cellula. Nelle cellule aerobiche, in presenza di ossigeno, il piruvato rientra nel Ciclo di Krebs, che è un insieme di reazioni grazie alle quali la cellula riesce produrre ulteriore ATP fino a dare come uniche sostanze di scarto acqua e anidride carbonica.
Il glucosio in eccesso rispetto alle esigenze della cellula in un dato istante viene immagazzinato sotto forma di glicogeno che è un polimero ramificato formato da mediamente 14 monomeri di glucosio legati fra loro.
Nel paragrafo precedente abbiamo detto che i carboidrati sono composti da catene di gruppi H-C-OH, ma questo è vero solo a grandi linee.
Vista la sua importanza, approfondiamo il discorso dissezionando proprio una molecola di glucosio per capire come è composta.
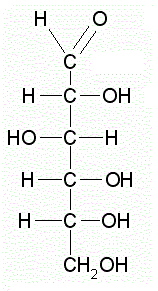 Quella rappresentata a sinistra è una molecola di glucosio in forma lineare.
Quella rappresentata a sinistra è una molecola di glucosio in forma lineare.
Come già detto gli atomi di carbonio sono legati a formare una catena essendo legati gli uni agli altri ed è possibile vedere i singoli anelli del tipo H-C-OH.
I vari atomi sono numerati dall’altro verso il basso dall’uno al sei.
Rispetto alla ripetizione del gruppo CHOH notiamo che ci sono due irregolarità. Il carbonio numero 1 non è impegnato nel solito gruppo HCOH ma in un gruppo CHO che è detto gruppo aldeidico inquanto è il gruppo funzionale caratteristico delle aldeidi. Per questo motivo il glucosio si definisce uno zucchero aldoso o, ricordando che si tratta anche di un esoso, di un aldoesoso.
Il carbonio in posizione 6 invece fa parte di un gruppo CH2OH che possiamo anche considerare come un gruppo HCOH a cui si è aggiunto un idrogeno per chiudere la catena.
In natura il glucosio non si trova tanto facilmente in forma lineare perchè, in soluzione, la molecola, tende a richiudersi su se stessa e a formare un anello. Il glucosio chiuso ad anello viene anche detto glucopiranosio.
Ciò che complica ulteriormente le cose è il fatto che le posizioni relative dei vari gruppi OH lungo la catena determinano differenti comportamenti delle molecole.
Innanzitutto emerge una prima suddivisione: avremo un glucosio D e un glucosio L, a seconda della posizione dell’ossidrile OH del carbonio numero 5.
Tale suddivisione viene fatta in analogia a quella della secondo il lavoro fatto da Fischer nel 1902. Quella rappresentata nella figura è convenzionalmente una struttura D che è poi la più importante in quando è l’unica utilizzata dagli organismi viventi.
Sul lavoro svolto da Fischer nella determinazione della struttura degli zuccheri semplici abbiamo parlato approfonditamente nell’articolo “La Prova di Fischer“.
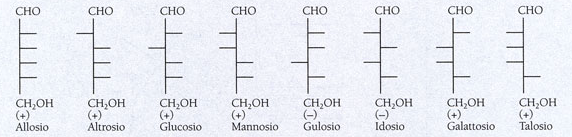
Come si può vedere i gruppi asimmetrici in una molecola di glucosio sono 4, quindi ci saranno 16 combinazioni di possibili orientamenti. Le 8 combinazioni della serie D sono riportate nella figura sotto.
Quando la molecola si richiude su se stessa, si ha una reazione fra l’ossidrile OH del carbonio 5 e l’ossigeno del gruppo aldeidico. Il doppio legame fra carbonio e ossigeno si rompe, l’ossigeno che non è più impegnato nel doppio legame si lega all’idrogeno dell’ossidrile di cui sopra, formando di fatto un altro ossidrile che sarà legato al carbonio 1. Rimangono quindi un ossigeno, quello legato al carbonio 5, e il carbonio 1 che si possono legare insieme formando l’anello.
Nell’immagine seguente sono rappresentati il glucosio alfa e beta in quanto, dopo la chiusura dell’anello, la posizione del nuovo ossidrile, può essere duplice.

Il primo zucchero a sinistra prende il nome alfa-D-glucopiranosio e quello a destra di beta-D-glucopiranosio. Entrambi hanno la proprietà di polarizzare la luce verso destra (da cui il nome destrosio) ma con angoli di rotazione differenti.
- Il fruttosio
Anche il fruttosio è un esoso, cioè uno zucchero formato da 6 atomi di carbonio. A differenza del glucosio che è un aldoesoso, il fruttosio è un chetoesoso.
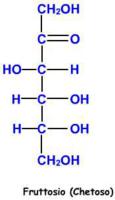 Per capire cosa significhi quest’ultima definizione, basta guardare anche in questo caso la struttura lineare della molecola.
Per capire cosa significhi quest’ultima definizione, basta guardare anche in questo caso la struttura lineare della molecola.
A differenza dal glucosio, notiamo che non è più presente il gruppo funzionale aldeidico in posizione 1.
Invece troviamo un gruppo chetonico -C=O in posizione 2.
Anche in questo caso il carbonio in posizione 5 determina l’appartenenza della catena alla serie D.
Anche per il fruttosio vale il discorso della trasformazione in anello anche se adesso avremo una struttura a 5 atomi che prende il nome di D-fruttofuranosio che può esistere sia in forma alfa che beta, accanto ad una struttura a 6 atomi detta D-fruttopiranosio.
Riassumendo, il fruttosio in soluzione può assumere 4 configurazioni cicliche, alfa e beta fruttopiranosio e alfa e beta fruttofuranosio.
Di queste la alfa-fruttopiranosio è presente solo in tracce e la percentuale delle altre tre dipende dalla temperatura. Se consideriamo che solo la beta-fruttopiranosio produce la sensazione di dolcezza, avremo che una soluzione di fruttosio e acqua produrrà una sensazione di dolcezza dipendente dalla temperatura.
Il fruttosio ha la proprietà di polarizzare la luce verso sinistra, per questo prende anche il nome di levulosio.
- Il galattosio
Per completare la carrellata dei monosaccaridi presenti negli alimenti citiamo anche il galattosio.
Si tratta di un epimero del glucosio. Infatti lo troviamo citato nella tabella sopra riportata in quanto differisce dal glucosio solo per l’orientamento del carbonio in posizione 4.
Il galattosio entra a far parte del lattosio che è un disaccaride di cui parleremo più avanti.
Da un punto di vista nutrizionale il nostro organismo è in grado di utilizzare il galattosio solo dopo averlo trasformato in glucosio a livello del fegato.
A partire dalla seconda parte di questo articolo inizieremo a far crescere la complessità delle molecole di zucchero, iniziando dai disaccaridi per arrivare fino agli amidi, con l’obiettivo di incontrare, alla fine del percorso, gli zuccheri nella forma di alimenti sulla nostra tavola.
La parola eterotrofia deriva dai due termini greci ἕτερος (éteros - diverso) e τροφή (trofé - nutrimento) e descrive la condizione in cui si trovano gli organismi viventi che non sono in grado di sintetizzare il proprio nutrimento autonomamente a partire da sostanze inorganiche.
Questi organismi hanno bisogno di attingere nell'ambiente i vari composti organici pre-sintetizzati da altri organismi, che sono invece detti autotrofi (ad es. tutte le piante che posseggono clorofilla).
Sono eterotrofi tutti gli animali (pluricellulari eterotrofi), i protozoi, i funghi e quasi tutti i batteri.
Il termine deriva dalla fusione di due parole del greco antico, γλυκύς (glykýs - dolce) e λύσις (lýsis - scissione).
Si tratta infatti di un processo metabolico mediante il quale una molecola di glucosio viene scissa in due molecole di piruvato al fine di generare molecole a più alta energia, come 2 molecole di ATP e 2 molecole di NADH per ogni molecola di glucosio utilizzata.
La glicolisi avviene nel citoplasma cellulare ed è il mezzo per ottenere energia più sfruttato in natura, soprattutto grazie alla sua anaerobioticità. Probabilmente esso si sviluppò con i primi procarioti circa 3,5 miliardi di anni fa.
Il processo completo consta di dieci fasi, ciascuna associata ad un particolare enzima. In una prima fase del processo, composta da cinque passaggi, viene consumata energia per ottenere dal glucosio molecole di un derivato del glucosio a più alta energia (gliceraldeide-3-fosfato).
La gliceraldeide-3-fosfato viene poi trasformata nella fase successiva, composta di altri cinque passaggi, in molecole nettamente meno energetiche di piruvato, con produzione di energia superiore a quella consumata nella prima fase. Il processo nel suo insieme è quindi di tipo catabolico, cioè in cui molecole più complesse ed energetiche vengono trasformate in altre più semplici e meno energetiche, con accumulo di energia.
La reazione finale della glicolisi è quindi:
glucosio + 2 NAD+ + 2 ADP + 2 Pi → 2 NADH + 2 piruvato + 2 ATP + 2 H2O + 2 H+
La produzione finale del piruvato è necessaria per il ciclo di Krebs che, in accoppiata alla fosforilazione ossidativa, grazie al consumo di ossigeno si produrranno altre molecole di ATP.
Come si può vedere dalla reazione totale riportata sopra, la glicolisi ha bisogno di 2 molecole di NAD+ e produce 2 molecole di NADH. E' necessario quindi che vi sia un meccanismo metabolico che permetta al NADH di ritrasformarsi in NAD+ per ricominciare il ciclo. Negli organismi che sono in grado di effettuare un metabolismo aerobico, questo compito è devoluto al complesso della respirazione cellulare. Mentre negli organismi anaerobici, vi sono sostanzialmente due strade:
piruvato + NADH + H+ → lattato + NAD+ (fermentazione lattica)
piruvato + NADH + H+ → etanolo + CO2 + NAD+ (fermentazione alcolica)
Le varie fasi della glicolisi sono descritte in moltissimi siti su internet, uno fra tutti Wikipedia, cui si rimanda per avere ulteriori dettagli.
La gliceraldeide è un carboidrato aldo-trioso, ovvero costituito da tre atomi di carbonio e contenente un gruppo aldeidico (CHO).
Il nome deriva dal fatto che la molecola della gliceraldeide è simile a quella del glicerolo la cui formula è
CH2OH-CHOH-CH2OH (glicerolo)
in cui uno dei due gruppi CH2OH è stato sostituito da un gruppo CHO ottenendo
CH2OH-CHOH-CHO (gliceraldeide)
Una caratteristica importante della gliceraldeide è la sua chiralità, cioè il fatto che la sua molecola possa esistere in due configurazioni spaziali speculari.
L'asimmetria spaziale si trasforma nella proprietà di polarizzare la luce che la attraversa in un senso piuttosto che nell'altro, cioè verso destra o verso sinistra.
Per questo motivo le due configurazioni sono denominate D e L e sono convenzionalmente rappresentate come in figura.
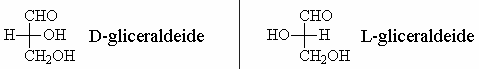
La D-gliceraldeide è presa a modello per la nomenclatura dei carboidrati.
Sono detti carboidrati della serie D quelli la cui disposizione dei sostituenti attorno al penultimo atomo di carbonio è simile a quella della D-glicerladeide. Quelli a configurazione speculare nell'ultimo carbonio chirale sono invece carboidrati della serie L.
Questa classificazione e nomenclatura si deve al lavoro del chimico tedesco premio nobel per la chimica nel 1902 Hermann Emil Fischer proprio per i suoi studi sulla chimica degli zuccheri.
Fischer poteva constatare gli effetti della chiralità delle molecole degli zuccheri sulla polarizzazione della luce, quindi aveva ben chiaro che la disposizione spaziale degli atomi nelle varie molecole doveva essere diversa ma con gli strumenti a sua disposizione, non era in grado di distinguere fra zuccheri enantiomerici.
Egli introdusse allora la convenzione secondo cui gli stereoisomeri (+) e (-) della gliceraldeide venivano designati rispettivamente come:
- D-gliceraldeide -> lo stereoisomero con l’ossidrile sul C2 a destra
- L-gliceraldeide -> lo stereoisomero con l’ossidrile sul C2 a sinistra
ben sapendo che c’era soltanto il 50% delle possibilità che questa assegnazione fosse corretta.
Fischer assunse quindi che la configurazione di queste molecole fosse quella riportata in figura.
Più tardi, nel 1954, con l’avvento della diffrazione ai raggi X, Bijvoet determinò la struttura dell’acido D-tartarico determinandone così la configurazione assoluta e constatando che l’assegnazione di Fischer (ossidrile a destra nella (+)-gliceraldeide) era corretta.
 -0
-0  )
)

Lascia un commento