La serie D
La formula bruta del glucosio era già nota in quanto può essere determinata con metodi quantitativi: C6H12O6.
Grazie a test chimici come il saggio di Tollens Fischer, aveva già appurato che il glucosio era uno zucchero riducente e che apparteneva alla categoria degli aldosi, cioè conteneva il gruppo CHO.
In precedenza Fischer aveva già affrontato il problema della di alcuni composti e, in particolare, della e aveva già studiato il fatto che potesse esistere in due forme da lui denominate D e L.
Per quanto riguarda il glucosio esso doveva essere “figlio” della D-gliceraldeide, che è lo zucchero aldoso più semplice presente negli organismi viventi. Partendo dalla D-gliceraldeide si ha lo schema sotto.
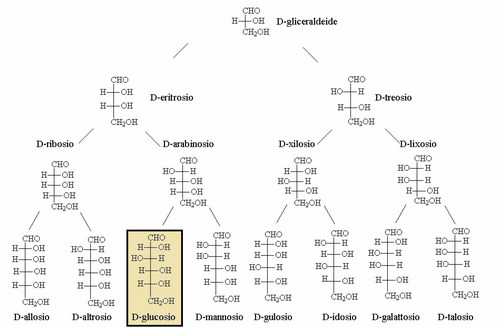
In questo schema sono riportati tutti i composti che si possono far discendere dalla D-gliceraldeide aggiungendo un gruppo H-C-OH orientato in entrambi i modi possibili.
L’unico gruppo che rimane orientato sempre nello stesso senso è quello relativo al carbonio C5, il penultimo, che è quello che identifica la “serie D“.
Notiamo che questa tabella rappresenta la “serie D” come la conosciamo oggi, con tutti i nomi dei vari composti e con i glucosio ben evidenziato al fianco dei suoi . All’epoca di Fischer tutto ciò era ancora da scoprire!
Fischer poteva isolare il glucosio dagli alimenti, infatti lo chiama normalmente zucchero d’uva, ma non sapeva a priori a quale casella corrispondesse.
Per la sua analisi, egli doveva partire dalle sostanze reali e imbucarle nelle celle corrette.
Per far questo utilizzò alcune osservazioni sperimentali.
La parola chiralità, deriva dal greco χειρ (kheir) che significa "mano".
Essa si riferisce a molecole in cui gli atomi, o gruppi di atomi, che le costituiscono, possono essere disposti nello spazio in maniera asimmetrica. Esistono quindi coppie di molecole che impiegano gli stessi atomi ma disposti nello spazio in modo speculare. Esattamente come le due mani che non possono essere sovrapposte identicamente l'una all'altra ma possono "guardarsi allo specchio". Due molecole siffatte sono dette enantiomeri.
L'enantiomeria è un caso particolare in cui le configurazioni sono due e sono una speculare all'altra. Facendo un siscorso più generale, ci possono essere delle molecole in cui gli atomi sono legati fra loro nello stesso modo, ma con orientamenti diversi e non sempre questi orientamenti sono tali da produrre delle copie speculari.
Queste molecole sono definite stereoisomeri e le copie non sovrapponibili sono dette epimeri.
Da un punto di vista fisico, gli stereoisomeri di una molecola hanno tutti le stesse proprietà, per esempio il colore, il punto di fusione, ecc. e chimicamente reagiscono tutte nello stesso modo con molecole non chirali.
Quello che invece cambia è il modo con cui reagiscono con altre molecole chirali. Siccome fra quelle organiche, di molecole chirali ce ne sono in abbondanza, il fatto che un composto sia un epimero piuttosto che un altro fa una differenza notevole. Per esempio fra gli zuccheri, quelli importanti biologicamente sono prevalentemente quelli della serie D caratterizzati da uno specifico orientamento di uno dei gruppi H-C-OH.
Lo studioso che ha dato un contributo fondamentale in questo ambito della chimica è Emil Fischer.
Nei suoi studi sulla stereoisomeria, Fischer definì quella che poi è stata chiamata proiezione di Fischer.
Si tratta di un insieme di convenzioni per rappresentare nel piano le posizioni degli atomi nello spazio.
Nell'immagine che segue si può vedere una molecola semplificata in cui si evidenzia un centro chirale, attraverso cui si fa passare il piano di proiezione, e 4 gruppi funzionali A, B, X, e Y che sono legati al centro chirale.
Nel processo di proiezione i quattro gruppi vengono a formare una croce in cui i segmenti A e B, oltre ad essere a destra e sinistra del centro, sono anche SOPRA il piano di proiezione, mentre gli altri due sono SOTTO.
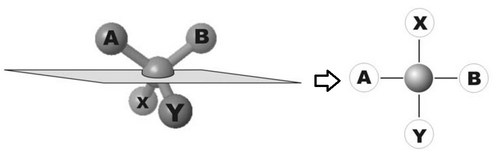
In questa rappresentazione, scambiare AB con XY significa far scavalcare tridimensionalmente il piano di proiezione, cioè si trasforma un enantiomero nell'altro.
Fischer applicò questa tecnica alla rappresentazione della gliceraldeide portando alla definizione della D-gliceraldeide e L-gliceraldeide.
Come abbiamo detto, gli zuccheri rilevanti da un punto di vista biologico sono quelli della serie "D", ma anche gli amminoacidi hanno caratteristiche stereoisomeriche e anche in questo caso, neglio organismi viventi, solo una famiglia, denominata "L" viene effettivamente utilizzata nelle cellule.
La gliceraldeide è un carboidrato aldo-trioso, ovvero costituito da tre atomi di carbonio e contenente un gruppo aldeidico (CHO).
Il nome deriva dal fatto che la molecola della gliceraldeide è simile a quella del glicerolo la cui formula è
CH2OH-CHOH-CH2OH (glicerolo)
in cui uno dei due gruppi CH2OH è stato sostituito da un gruppo CHO ottenendo
CH2OH-CHOH-CHO (gliceraldeide)
Una caratteristica importante della gliceraldeide è la sua chiralità, cioè il fatto che la sua molecola possa esistere in due configurazioni spaziali speculari.
L'asimmetria spaziale si trasforma nella proprietà di polarizzare la luce che la attraversa in un senso piuttosto che nell'altro, cioè verso destra o verso sinistra.
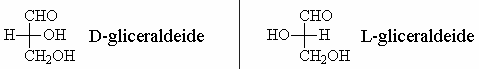
Per questo motivo le due configurazioni sono denominate D e L e sono convenzionalmente rappresentate come in figura.

La D-gliceraldeide è presa a modello per la nomenclatura dei carboidrati.
Sono detti carboidrati della serie D quelli la cui disposizione dei sostituenti attorno al penultimo atomo di carbonio è simile a quella della D-glicerladeide. Quelli a configurazione speculare nell'ultimo carbonio chirale sono invece carboidrati della serie L.
Questa classificazione e nomenclatura si deve al lavoro del chimico tedesco premio nobel per la chimica nel 1902 Hermann Emil Fischer proprio per i suoi studi sulla chimica degli zuccheri.
Fischer poteva constatare gli effetti della chiralità delle molecole degli zuccheri sulla polarizzazione della luce, quindi aveva ben chiaro che la disposizione spaziale degli atomi nelle varie molecole doveva essere diversa ma con gli strumenti a sua disposizione, non era in grado di distinguere fra zuccheri enantiomerici.
Egli introdusse allora la convenzione secondo cui gli stereoisomeri (+) e (-) della gliceraldeide venivano designati rispettivamente come:
- D-gliceraldeide -> lo stereoisomero con l’ossidrile sul C2 a destra
- L-gliceraldeide -> lo stereoisomero con l’ossidrile sul C2 a sinistra
ben sapendo che c’era soltanto il 50% delle possibilità che questa assegnazione fosse corretta.
Fischer assunse quindi che la configurazione di queste molecole fosse quella riportata in figura.
Più tardi, nel 1954, con l’avvento della diffrazione ai raggi X, Bijvoet determinò la struttura dell’acido D-tartarico determinandone così la configurazione assoluta e constatando che l’assegnazione di Fischer (ossidrile a destra nella (+)-gliceraldeide) era corretta.
La parola chiralità, deriva dal greco χειρ (kheir) che significa "mano".
Essa si riferisce a molecole in cui gli atomi, o gruppi di atomi, che le costituiscono, possono essere disposti nello spazio in maniera asimmetrica. Esistono quindi coppie di molecole che impiegano gli stessi atomi ma disposti nello spazio in modo speculare. Esattamente come le due mani che non possono essere sovrapposte identicamente l'una all'altra ma possono "guardarsi allo specchio". Due molecole siffatte sono dette enantiomeri.
L'enantiomeria è un caso particolare in cui le configurazioni sono due e sono una speculare all'altra. Facendo un siscorso più generale, ci possono essere delle molecole in cui gli atomi sono legati fra loro nello stesso modo, ma con orientamenti diversi e non sempre questi orientamenti sono tali da produrre delle copie speculari.
Queste molecole sono definite stereoisomeri e le copie non sovrapponibili sono dette epimeri.
Da un punto di vista fisico, gli stereoisomeri di una molecola hanno tutti le stesse proprietà, per esempio il colore, il punto di fusione, ecc. e chimicamente reagiscono tutte nello stesso modo con molecole non chirali.
Quello che invece cambia è il modo con cui reagiscono con altre molecole chirali. Siccome fra quelle organiche, di molecole chirali ce ne sono in abbondanza, il fatto che un composto sia un epimero piuttosto che un altro fa una differenza notevole. Per esempio fra gli zuccheri, quelli importanti biologicamente sono prevalentemente quelli della serie D caratterizzati da uno specifico orientamento di uno dei gruppi H-C-OH.
Lo studioso che ha dato un contributo fondamentale in questo ambito della chimica è Emil Fischer.
Nei suoi studi sulla stereoisomeria, Fischer definì quella che poi è stata chiamata proiezione di Fischer.
Si tratta di un insieme di convenzioni per rappresentare nel piano le posizioni degli atomi nello spazio.
Nell'immagine che segue si può vedere una molecola semplificata in cui si evidenzia un centro chirale, attraverso cui si fa passare il piano di proiezione, e 4 gruppi funzionali A, B, X, e Y che sono legati al centro chirale.
Nel processo di proiezione i quattro gruppi vengono a formare una croce in cui i segmenti A e B, oltre ad essere a destra e sinistra del centro, sono anche SOPRA il piano di proiezione, mentre gli altri due sono SOTTO.

In questa rappresentazione, scambiare AB con XY significa far scavalcare tridimensionalmente il piano di proiezione, cioè si trasforma un enantiomero nell'altro.
Fischer applicò questa tecnica alla rappresentazione della gliceraldeide portando alla definizione della D-gliceraldeide e L-gliceraldeide.

Come abbiamo detto, gli zuccheri rilevanti da un punto di vista biologico sono quelli della serie "D", ma anche gli amminoacidi hanno caratteristiche stereoisomeriche e anche in questo caso, neglio organismi viventi, solo una famiglia, denominata "L" viene effettivamente utilizzata nelle cellule.
 -0
-0  )
)

Lascia un commento