Il sapone
 Le prime testimonianze dell’esistenza del sapone risalgono alla Mesopotamia, intorno al 2800 a.C., epoca cui si fa risalire un ritrovamento, effettuato negli scavi della zona di Babilonia, di una sostanza simile a quello che oggi chiamiamo “Sapone”. La scoperta del sapone probabilmente si deve all’osservazione dell’effetto della liscivia sul grasso animale o vegetale presente sugli indumenti che si cercava di lavare una volta che questi venivano sottoposti al calore.
Le prime testimonianze dell’esistenza del sapone risalgono alla Mesopotamia, intorno al 2800 a.C., epoca cui si fa risalire un ritrovamento, effettuato negli scavi della zona di Babilonia, di una sostanza simile a quello che oggi chiamiamo “Sapone”. La scoperta del sapone probabilmente si deve all’osservazione dell’effetto della liscivia sul grasso animale o vegetale presente sugli indumenti che si cercava di lavare una volta che questi venivano sottoposti al calore.
Da un punto di vista chimico si tratta di sali di acidi carbossilici a lunga catena e si ottengono tramite una reazione di .
Quindi per creare il sapone si tratta di far reagire un grasso, sego o olio vegetale (tipicamente olio di oliva), con una base alcalina come idrossido di sodio o di potassio (che nella liscivia erano presenti essendo contenuti nella cenere usata per prepararla).
Gli ingredienti per la creazione, anche domestica, del sapone sono reperibili con relativa facilità e su internet è possibile trovare varie ricette per produrlo in casa, sia utilizzando la soda caustica che utilizzando la cenere.
Partendo dall’olio di oliva si ottengono i famosi Sapone di Marsiglia e il Sapone di Castiglia, se si utilizza l’idrossido di sodio (soda) ottenendo un prodotto di consistenza dura. Se si utilizza l’idrossido di potassio (potassa) si ottiene un sapone di consistenza molle.
Fino alla fine 1800 il sapone era un bene che solo nobili e persone estremamente ricche potevano permettersi, sia a causa degli elevati costi di produzione, che prevedeva l’uso di enormi quantità di legna, sia per le tasse particolarmente elevate che vi erano applicate.
Finalmente, nel 1879 Nicolas Leblanc scoprì quello che è stato poi denominato per preparare la liscivia caustica a partire da una soluzione salina.
Oggi il processo Leblanc è stato soppiantato dal , brevettato nel 1861 dal chimico belga Ernest Solvay, ma ha avuto senz’altro il merito di rendere accessibile l’uso del sapone ad un più ampio pubblico di fruitori.
Questi tipi di sapone, prodotti con materie prime naturali, riscuotono oggi un rinnovato successo nell’opinione pubblica. Notiamo però che la funzione principale del sapone di sciogliere il grasso sporco e rimuoverlo, se applicato alla cura del corpo, finisce per rimuovere anche lo strato di grasso lievemente acido (circa pH 5,5) che la pelle produce per proteggere se stessa.
Il sapone di Marsiglia inoltre, nella sua formulazione originaria, è da neutro ad alcalino e come tale, oltre a liberare la pelle del suo strato protettivo, la danneggia e la irrita.
Per ovviare a questi inconvenienti i saponi per uso personale vengono spesso addizionati di sostanze grasse e acidificanti per riportarli ad un livello di maggiore compatibilità con la pelle umana. Il giudizio su questo tipo di saponi “dal sapore antico” va espresso con molta attenzione perchè il potere lavante del sapone è praticamente sempre lo stesso e le sostanze aggiunte spesso servono solo a migliorare l’aspetto e/o il profumo del prodotto (e far lievitare il prezzo).
Una volta chiarita l’azione dei tensioattivi nella rimozione dello sporco, il sapone di Marsiglia è stato presto sostituito o affiancato da sostanze più specifiche ed efficienti per le varie funzioni, come vedremo nel prossimo paragrafo.
La saponificazione è una reazione di idrolisi effettuata su un estere in ambiente basico. Infatti come mostrato sotto, viene fatta avvenire utilizzando come reagente una base forte come l'idrossido di sodio o di potassio.
Si parla di saponificazione quando l'estere di partenza ha un peso molecolare relativamente elevato, con una catena di almeno 12 atomi di carbonio.
Il nome saponificazione deriva dal fatto che questa reazione porta alla formazione del sapone di uso comune.
Gli esteri sono sostanze organiche formate da due radicali organici legati dal gruppo funzionale [-O-C=O-]. Nel caso della preparazione del comune sapone, si parte dai trigliceridi di acidi grassi presenti in grassi animali, come il sego bovino, o olii vegetali come l'olio di oliva.
La reazione che avviene in questo caso è descritta dallo schema seguente:
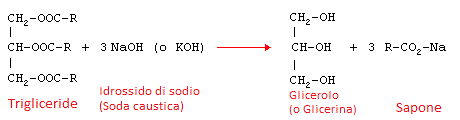
In cui vediamo a sinistra la struttura dell'estere formato dal glicerolo (detto anche glicerina) più i radicali "R" dell'acido grasso. Nel caso dell'olio di oliva questo radicale potrebbe essere quello dell'acido oleico CH3(CH2)7CH=CH(CH2)7COOH di cui l'olio di oliva è costituito per buona parte.
Il risultato della reazione è glicerolo più il sale dell'acido grasso considerato che nell'esempio, avendo usato idrossido di sodio nei reagenti (NaOH) sarà un sale di sodio.
Il processo Leblanc è procedimento industriale che permette di produrre il carbonato di sodio (soda) a partire da una soluzione salina di cloruro di sodio (sale marino) e carbonato di calcio (calcare) mediante l'utilizzo di acido solforico e carbone.
Esso fu brevettato nel settembre del 1790 dal medico francese Nicolas Leblanc e conobbe subito una rapida diffusione specialmente in Francia e Inghilterra.
Il processo prevede due step successivi di reazioni chimiche:
nel primo step il cloruro di sodio viene convertito in solfato di sodio
![]()
nel secondo step, aggiungendo il carbonato di calcio e il carbone, si ottiene il carbonato di sodio.
![]()
A livello industriale, come si può vedere dalla prima reazione, fra i prodotti troviamo il solfato di sodio che rientra nel secondo step ma anche una notevole quantità di acido cloridrico gassoso. Nei primi decenni di attività delle fabbriche Leblanc l’acido cloridrico veniva disperso direttamente nell’aria.
In alternativa, specie in Francia, gli scarichi subivano un lavaggio in giare di grès piene d’acqua collegate in serie, oppure venivano convogliati in una grande camera di piombo dove reagivano con vapori ammoniacali prodotti dalla calcinazione di scarti animali, dando luogo alla formazione di cloruro d’ammonio. Si è valutato che negli anni ’40 del XIX secolo, in Inghilterra, nell’area del Merseyside, circa 100 mila tonnellate di sale siano state convertite in alcali, dando come sottoprodotto 60 mila tonnellate di acido.
 Gli addetti alla produzione che, prima dell’introduzione dei forni meccanici (mostrati nell'immagine), mescolavano manualmente l’acido solforico con il sale in grandi vasche di ghisa, si ammalavano rapidamente.
Gli addetti alla produzione che, prima dell’introduzione dei forni meccanici (mostrati nell'immagine), mescolavano manualmente l’acido solforico con il sale in grandi vasche di ghisa, si ammalavano rapidamente.
A causa del gas il bestiame soffocava, le popolazioni circostanti soffrivano di vari disturbi, i manufatti metallici e i materiali da costruzione venivano corrosi, la vegetazione e le colture agricole deperivano, i fiumi diventavano “neri come l’inchiostro” e le piogge acide completavano
l’opera di devastazione.
Inoltre il solfuro di calcio, anch'esso nocivo, veniva accumulato senza protezione alcuna all’esterno delle fabbriche, cosicché per azione delle piogge acide produceva idrogeno solforato, tossico e maleodorante.
Nel 1863 fu promulgata la legge denominata "Alkali Act" che cercava di porre una regolamentazione allo smaltimento dell'acido cloridrico prodotto durante il processo Leblanc e in seguito l'invenzione del processo Solvay che permetteva di ottenere il carbonato di sodio senza scarti tossici determinarono l'abbandono del processo Leblanc su scala industriale.
Il processo Solvay per la produzione del carbonato di sodio deve il suo nome al chimico belga Ernest Solvay che lo brevettò nell'aprile del 1861.
Grazie al processo Solvay si può produrre a livello industriale sia il carbonato acido di sodio o idrogenocarbonato di sodio NaHCO3 (noto comunemente come bicarbonato di uso domestico) sia il carbonato di sodio Na2CO3 usato in altri procedimenti industriali come per esempio quello per la produzione del sapone.
Il processo solvay è usato ancora oggi, anche se in declino in quanto risulta più economico ricavare il carbonato di sodio sfruttando il "trona", che è un minerale (carbonato acido di sodio biidrato) estraibile dai laghi salati di tutto il mondo.
Nel processo Solvay si sfrutta la differenza di solubilità in acqua a 25°c tra NH4Cl (37,3 g/100 cc di soluzione) ed il NaHCO3 formato (10,0 g/100 cc) nella seguente reazione tra una soluzione di NaCl (cloruro di sodio) ed NH3 (ammoniaca) con CO2 fatta gorgogliare nella soluzione dove forma acido carbonico (H2CO3):
NaCl + NH3 + H2CO3 → NaHCO3 + NH4Cl
Questa reazione é di equilibrio, ma viene continuamente spostata a destra dalla precipitazione del sale che viene così separato per filtrazione.
La reazione in acqua del bicarbonato di sodio é leggermente basica per l’ idrolisi dello ione HCO3- ; una soluzione di 50 g/l, infatti, ha un pH = 8,5 a 25°c.
Una sua proprietà chimica importantissima, sfruttata nel processo Solvay, é che si decompone sopra i 50°C in carbonato di sodio (Na2CO3) e anidride carbonica (CO2):
2NaHCO3 → Na2CO3 + CO2 + H2O
Così il prossimo passo del processo Solvay consiste nel recuperare il NaHCO3 formato e scaldarlo decomponendolo a circa 70°C.
Il cloruro di ammonio NH4Cl della soluzione viene riciclato recuperando l’ NH3 utilizzando l'ossido di calcio (calce viva) secondo la seguente reazione:
CaO + H2O → Ca(OH)2
Ca(OH)2 + 2 NH4Cl → CaCl2 + 2 NH3 + 2 H2O
Siccome l'ammoniaca viene reimmessa nel ciclo, l'unico prodotto di scarto del processo è il cloruro di calcio CaCl2 che può essere commercializzato e utilizzato come anticongelante.
Il Na2CO3 è un sale alcalino e caustico. Una soluzione di 50 g/l a 25°C ha un pH di 11,5
 -0
-0  )
)

10 Aprile 2020 at 15:39
Ciao sono Aldo da Albania come funziona per compra dedersivo da voi per ingreso a paeze mioa
10 Aprile 2020 at 16:56
Ciao Aldo,
mi spiace. Questo non è un sito di e-commerce.
Sei comunque il benvenuto se vuoi continuare la lettura degli articoli.